Efficacité et innocuité de l’hydroxychloroquine en prophylaxie contre la COVID19 symptomatique : nouvelle étude randomisée en double aveugle
Les contenus de ce site ne peuvent donc pas constituer des provocations à abandonner ou à s’abstenir de suivre un traitement médical thérapeutique ou prophylactique, ni non plus des provocations à adopter des pratiques ayant une finalité thérapeutique ou prophylactique.
Image par beauty_of_nature de Pixabay
Dans le contexte actuel où certains contestent encore l’efficacité de l’hydroxychloroquine, il nous parait important de vous informer de la publication de ce nouvel essai clinique randomisé en double aveugle qui vient confirmer, via une méta-analyse incluant cet essai et des essais cliniques randomisés similaires , une efficacité et une innocuité pour cette molécule en chinioprophylaxie [prévention] dans le cadre de la Covid19.
Citation: Schilling WHK, Mukaka M, Callery JJ, Llewelyn MJ, Cruz CV, Dhorda M, et al. (2024) Evaluation of hydroxychloroquine or chloroquine for the prevention of COVID-19 (COPCOV): A double-blind, randomised, placebo-controlled trial. PLoS Med 21(9): e1004428. https://doi.org/10.1371/journal.pmed.1004428
Lien de l’article en ligne : https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1004428
Contexte
L’hydroxychloroquine (HCQ) s’est révélée inefficace dans le traitement des patients hospitalisés pour la maladie à coronavirus 2019 (COVID-19), mais des incertitudes subsistent quant à son innocuité et son efficacité en chimioprévention. Les précédents essais contrôlés randomisés (ECR) de chimioprévention n’ont pas démontré individuellement de bénéfice de l’HCQ contre la COVID-19 et, bien que la méta-analyse ait suggéré un bénéfice clinique, les directives déconseillent son utilisation.
Méthodes et résultats
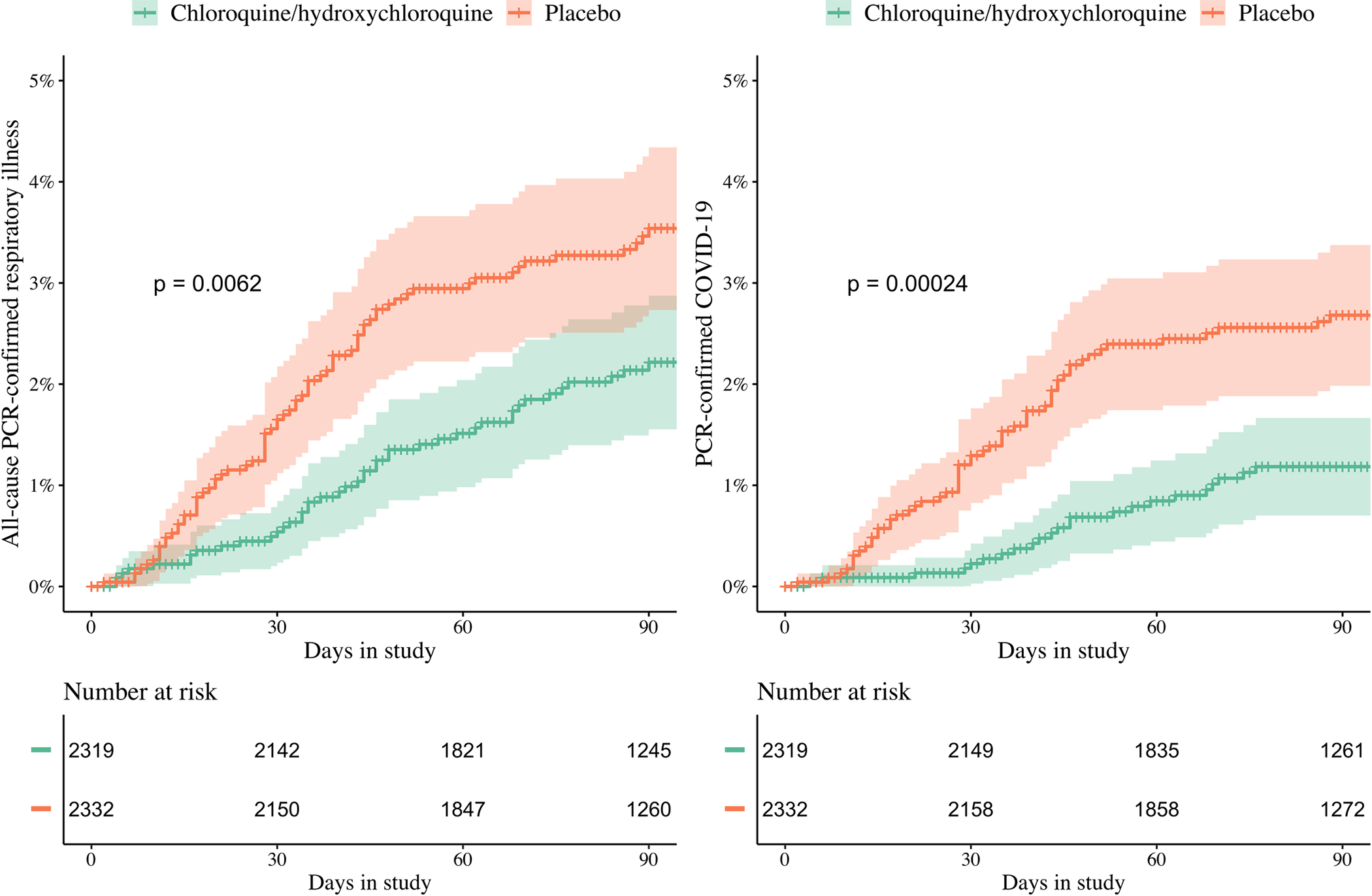
Français Des participants adultes en bonne santé issus du milieu de la santé, puis de la communauté, ont été recrutés dans 26 centres de 11 pays pour un essai randomisé en double aveugle, contrôlé par placebo, sur la chimioprévention de la COVID-19. L’HCQ a été évaluée en Europe et en Afrique, et la chloroquine (CQ) a été évaluée en Asie (les deux équivalents de base de 155 mg une fois par jour). Le critère d’évaluation principal était la COVID-19 symptomatique, confirmée par PCR ou séroconversion au cours de la période de suivi de 3 mois. Les critères d’évaluation secondaires et tertiaires étaient : infection asymptomatique par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) confirmée en laboratoire ; gravité des symptômes de la COVID-19 ; maladie respiratoire aiguë symptomatique toutes causes confirmée par PCR (y compris l’infection par le SARS-CoV-2) ; nombre de jours de travail perdus déclarés par les participants ; marqueurs génétiques et biochimiques de base associés à la COVID-19 symptomatique, à la maladie respiratoire et à la gravité de la maladie (non rapportés ici) ; et des analyses économiques de la santé sur les coûts et les mesures de la qualité de vie de la prophylaxie par HCQ et CQ (non rapportées ici).
Les analyses primaires et de sécurité ont été menées dans la population en intention de traiter (ITT). Le recrutement de 40 000 participants (20 000 dans le groupe HCQ, 20 000 dans le groupe CQ) était prévu mais n’a pas été possible en raison de retards prolongés résultant de controverses sur l’efficacité et les effets indésirables liés à l’utilisation de l’HCQ, du déploiement du vaccin dans certains pays et d’autres facteurs. Entre le 29 avril 2020 et le 10 mars 2022, 4 652 participants (46 % de femmes) ont été recrutés (HCQ/CQ n = 2 320 ; placebo n = 2 332). L’âge médian (IQR) était de 29 ans (23 à 39). Des infections par le SARS-CoV-2 (symptomatiques et asymptomatiques) sont survenues chez 1 071 participants (23 %). Pour le critère d’évaluation principal, l’incidence de la COVID-19 symptomatique était de 240/2 320 dans le groupe HCQ/CQ contre 284/2 332 dans le groupe placebo (risque relatif (RR) 0,85 [intervalle de confiance à 95 %, 0,72 à 1,00 ; p = 0,05]).
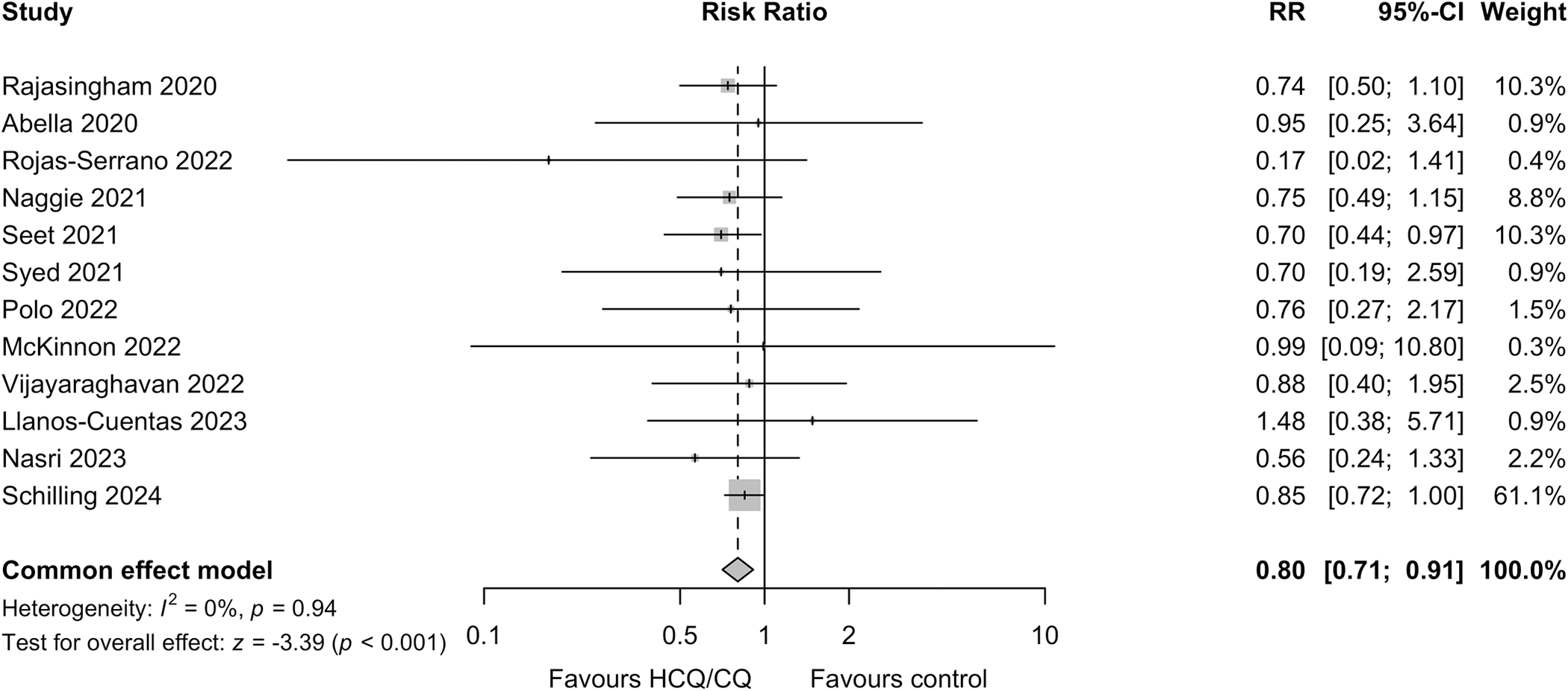
Pour les critères secondaires et tertiaires, des infections asymptomatiques au SARS-CoV-2 sont survenues chez 11,5 % des receveurs d’HCQ/CQ et 12,0 % des receveurs du placebo : RR : 0,96 (IC à 95 %, 0,82 à 1,12 ; p = 0,6). Il n’y a eu aucune différence dans la gravité des symptômes entre les groupes et aucune maladie grave. La chimioprévention par HCQ/CQ a été associée à moins d’infections respiratoires toutes causes confondues confirmées par PCR (principalement le SARS-CoV-2) : RR 0,61 (IC à 95 %, 0,42 à 0,88 ; p = 0,009) et moins de jours d’arrêt de travail pour cause de maladie : 104 jours pour 1 000 participants sur 90 jours (IC à 95 %, 12 à 199 jours ; p < 0,001). La méta-analyse prédéfinie de tous les ECR pré-exposition publiés indique que la prophylaxie HCQ/CQ a fourni un effet protecteur modéré contre la COVID-19 symptomatique : RR 0,80 (IC à 95 %, 0,71 à 0,91). Les deux médicaments ont été bien tolérés sans aucun événement indésirable grave (EIG) lié au médicament. Les limites de l’étude comprennent la taille de l’étude plus petite que prévu, le nombre relativement faible d’infections confirmées par PCR et la précision comparative plus faible des critères d’évaluation sérologiques (en particulier, la méthode adaptée des taches de sang séché) par rapport au critère d’évaluation PCR. L’essai COPCOV a été enregistré auprès de ClinicalTrials.gov ; numéro NCT04303507 .
Interprétation
Dans cet essai randomisé en double aveugle contrôlé par placebo à grande échelle, l’HCQ et la CQ se sont révélées sûres et bien tolérées dans la chimioprévention de la COVID-19, et une méta-analyse incluant cet essai et des ECR similaires a démontré un bénéfice protecteur modéré.